Download hier een pdf van dit artikel.
Drinkwater in Nederland is veilig en betrouwbaar. Dit wordt door de consument als vanzelfsprekend ervaren, maar dat is het niet. In Nederland wordt veel zorg besteed aan het produceren van veilig drinkwater, waardoor nadesinfectie met chloor in het distributienet niet nodig is. Dit betekent wel dat er geen chemische barrière aanwezig is in het distributienet en dat ziekteverwekkende bacteriën, als ze in het systeem terecht komen door buisbreuken of lekkages, enige tijd in het water kunnen overleven en mogelijk consumenten besmetten. Deze situaties worden door afspraken over hygiënisch werken [1] en een uitgebreid bacteriologisch meetprogramma zoveel mogelijk gereduceerd.
Vooral hygiënisch werken na een ingreep in het distributienet is een essentiële factor om drinkwater betrouwbaar te houden. Het voorkomen van verontreinigingen is vele malen effectiever dan achteraf te moeten reinigen en desinfecteren. Omdat het onmogelijk is om alle water te onderzoeken wordt in kleine watervolumes beoordeeld of er schoon en verantwoord gewerkt is. Na een ingreep worden drinkwatermonsters onderzocht op de fecale indicator-organismen E. coli en enterokokken. Dat gebeurt tot op heden met de (wettelijk voorgeschreven) klassieke kweekmethoden [2, 3]. Deze analyses duren minimaal 16 en maximaal 44 uur. In situaties waarin het water niet direct ter beschikking wordt gesteld aan de consument, is dit geen probleem. Echter, soms is het noodzakelijk dat het water na een ingreep direct weer wordt doorgeleverd. In die gevallen is er een onzekerheid aangaande de betrouwbaarheid gedurende minimaal 44 uur. Dit wordt meestal ondervangen door het verstrekken van een kookadvies, maar hiermee worden niet alle consumenten in een risicogebied beschermd; bekend is dat het kookadvies slechts ongeveer de helft van de mensen bereikt. De andere helft loopt daarmee een risico. Dat is één van de redenen om de analysetechnieken voor de fecale indicatoren te versnellen.
E. coli snel aantonen
In 2009 heeft Waterlaboratorium Noord een snelle analyse ontwikkeld voor E. coli, gebaseerd op het aantonen van genetisch materiaal (afbeelding 1). Daarbij wordt gebruik gemaakt van apparatuur waarmee desoxyribonucleïnezuur (DNA) buiten de bacteriecel in grote hoeveelheden wordt vermenigvuldigd en vervolgens aangetoond door kleuring. De detectiegrens ligt hierbij rond de 100 bacteriën per 100 ml water. Door nu niet het DNA maar het RNA (ribonucleïnezuur) van de bacterie te vermenigvuldigen is er een detectiegrens van 1 bacterie per 100 ml haalbaar. Dit is dezelfde grens die de wet voorschrijft voor de klassieke methoden door middel van kweek.
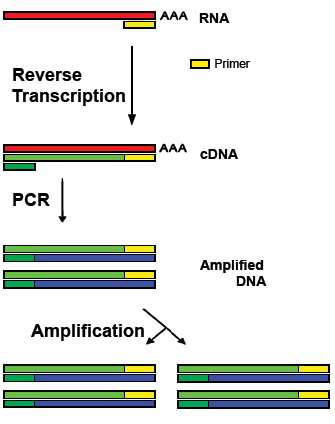
Afbeelding 1. Principe van de Reverse Transcription Polymerase Chain Reaction (RT-PCR) voor het aantonen van rRNA afkomstig van micro-organismen
(Bron : http://en.wikipedia.org/wiki/Reverse_transcription_polymerase_chain_reaction)
Deze techniek staat bekend als RT-PCR (Reverse Transcription Polymerase Chain Reaction). WLN heeft de techniek aangepast voor het detecteren van E. Coli. In 2010 heeft WLN de E. coli RT-PCR door de Raad voor Accreditatie laten accrediteren. Sindsdien wordt in risicosituaties bij de waterbedrijven van Groningen en Drenthe naast de klassieke kweekmethoden ook deze snelle methode uitgevoerd.
Enterokokken snel aantonen
Om met zekerheid te kunnen aangeven of het water hygiënisch betrouwbaar is, dienen naast E. coli ook enterokokken te worden geanalyseerd. Ook hiervoor heeft WLN nu een snelle methode ontwikkeld. Daarbij was de uitdaging onderscheid te kunnen maken tussen fecale en niet-fecale enterokokken.
De klassieke kweekmethoden zijn namelijk niet erg specifiek; ze tonen naast enterokokken van fecale oorsprong (de zogeheten intestinale enterokokken) nog enkele andere soorten aan, die mogelijk afkomstig zijn uit feces maar die ook voorkomen en groeien in de omgeving (planten, zand, insecten, water) [4, 5, 6]. Deze laatste groep heeft geen directe relatie met fecale besmetting en dus ook niet met ziekteverwekkers.
Het aantonen van deze soorten in de kweek wordt gezien als een niet te voorkomen bijgroei (zie noot in de NEN-EN-ISO 7889-1/2) en geeft dus mogelijk ‘vals alarm’. Tegenwoordig kunnen de laboratoria het verschil tussen de intestinale enterokokken en de overige enterokokken wel maken door het gebruik van de MALDI-TOF techniek [7]. Deze techniek is heel gevoelig, maar is ook afhankelijk van gekweekt materiaal.
WLN ging op zoek naar een techniek die én snel is én intestinale en overige enterokokken van elkaar kan onderscheiden. Uitgangspunt was de definitie van intestinale enterokokken zoals die wordt gehanteerd door de Wereld Gezondheids Organisatie [8]. Volgens die definitie bestaat de groep intestinale enterokokken uit de soorten E. faecalis, E. faecium, E. hirae en E. durans. WLN heeft de snelle RT-PCR nu ook geschikt gemaakt voor het detecteren van deze soorten.
In oktober 2014 is de validatie van de RT-PCR voor enterokokken afgerond. De methode wordt nu voorgedragen voor accreditatie.
Kwalitatieve methode
Beide snelle analysemethoden (voor E. Coli en voor intestinale enterokokken) zijn gebaseerd op de aanwezigheid van het 16S ribosomaal RNA in de bacteriecel. De hoeveelheid ribosomaal RNA (rRNA) is afhankelijk is van de fysiologische toestand van de bacteriecel, hetgeen betekent dat de RT-PCR-methoden niet kwantitatief zijn [9].
Bacteriën vers uit het maagdarmkanaal zitten nog vol energie en voedingsstoffen en zijn volop in ontwikkeling. De cellen bevatten dan nog veel kopieën van het rRNA (enkele tienduizenden per cel). Een bacteriecel die al een tijdje in het water aanwezig is zal niet veel activiteit meer vertonen en in een rustfase zijn. Het aantal rRNA-kopieën zal in deze cel dan ook veel lager zijn. Dode of bijna dode bacteriecellen bevatten geen rRNA meer en worden dan ook niet aangetoond in de RT-PCR-analyse.
Dat de snelle analysemethoden de mate van besmetting niet kunnen kwantificeren is voor de beoogde toepassing van ondergeschikt belang. Om fecale micro-organismen in drinkwater aan te tonen volstaat het een methode te kiezen die een enkele bacteriecel in 100 ml kan detecteren (of ander gewenst volume). Het aantreffen van E. coli of enterokokken is een aanwijzing voor een fecale besmetting en daaropvolgend dient er actie te worden ondernomen, ongeacht de hoeveelheid.
Validatie
Bij zowel de E. coli als de enterokokken RT-PCR is met controlemonsters en praktijkmonsters bekeken of de resultaten overeenkomen met die van de wettelijke kweekmethoden.
In tabel 1 staan de prestatiekenmerken, bepaald volgens NEN-EN-ISO 16140 [10], die daarbij zijn gevonden.
Tabel 1. Vergelijking van de resultaten van de snelle RT-methoden met die van de wettelijk voorgeschreven analysemethoden (kweek) voor E. Coli en enterokokken
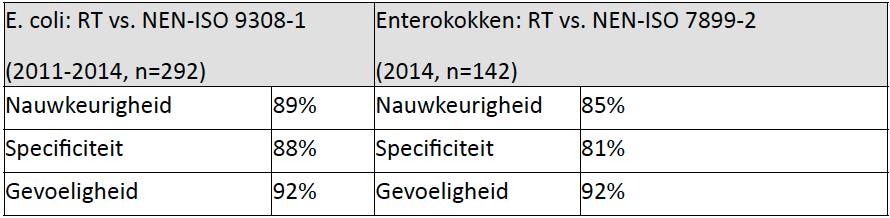
De resultaten van de snelle technieken en van de kweekmethoden liggen dicht bij elkaar en voldoen ruimschoots aan de validatie-eisen uit ISO.
Praktijkwaarde snelle analysemethoden
E. coli RT-PCR
In Groningen en Drenthe zijn goede ervaringen opgedaan met de snelle E. coli methode (RT-PCR E. coli) van WLN. Bij ingrepen waar een verhoogd risico bestaat door omstandigheden waaronder reparaties uitgevoerd moeten worden is binnen 4 uur bekend of E. coli aanwezig is. Bij reparaties waar doorlevering noodzakelijk was, is vanaf 2010 naast de klassieke methode ook de snelle methode voor E. coli gebruikt om de veiligheid van de consument eerder te kunnen garanderen. In drie jaar tijd zijn er 400 monsters geanalyseerd met RT-PCR E. coli en E. coli kweekmethode (NEN-EN-ISO 9308-1).
Enterokokken TR-PCR
Hoewel de snelle enterokokken-analyse nog niet geaccrediteerd is heeft ze haar bruikbaarheid in een spoedsituatie al bewezen. Bij een standaard monitoringscontrole van reinwatertanks in Ter Apel werden in het weekend coliformen en enterokokken aangetoond. De MALDI-TOF-techniek (matrix assisted laser desorption/ionisation time-of-flight analyzer) toonde aan dat het ging om respectievelijk Citrobacter freundii en Enterococcus phoeniculicola.
Van de coliforme bacterie is bekend dat hij in feces kan voorkomen en dat hij ook kan nagroeien in het water [11]. Van de aangetroffen enterokokken was alleen bekend dat ze ooit een keer waren aangetroffen bij een tropische vogel [12]. Op basis van deze informatie werd besloten om kookadvies te verstrekken aan het hele voorzieningsgebied achter de reinwatertanks.
De volgende dag zijn in het voorzieningsgebied en de reinwatertanks monsters genomen voor de snelle E. coli methode en de snelle enterokokken-methode. In overleg met de Inspectie Leefomgeving en Transport (ILT) werd besloten dat het resultaat van de snelle methoden leidend zou zijn voor het opheffen of in stand houden van het kookadvies.
Dit leidde ertoe dat na een tweede controleronde het kookadvies alweer ingetrokken kon worden, een tijdwinst van bijna 40 uur ten opzichte van de klassieke kweekmethoden.
En hoe verder
Iedereen is het erover eens dat moleculaire technieken een grote toegevoegde waarde hebben bij waterkwaliteitsmonitoring. Dat we in de komende jaren meer gebruik gaan maken van deze nieuwe technieken is evident. Deze methoden voor het aantonen van fecale indicatoren zijn een mooie aanzet tot het introduceren van routinematige PCR-analyses. Momenteel lopen er meerdere trajecten om de E. coli RT-PCR zowel nationaal als internationaal erkend te krijgen als valide analysemethode voor het aantonen van E. coli in drinkwater. De eerste signalen zijn positief en daarmee loopt Nederland voorop in dit veld.
Literatuur
- Hygiënecode Drinkwater (2010). Opslag, transport en distributie. BTO 2001.175, 2e editie.
- Water - Detectie en enumeratie van Escherichia coli en bacteriën van de coligroep - Deel 1: Methode met membraanfiltratie. NEN-EN-ISO 9308-1 (2005).
- Water - Detectie en enumeratie van Enterokokken - Deel 2: Methode met membraanfiltratie. NEN-EN-ISO 7889-2 (2005).
- Byappanahalli, M.N., Nevers, N.B., Korajkic, A.,. Staley Z. R., Harwood V. J. (2012). Enterococci in the Environment. Microbiol. Mol. Biol. Rev. 76(4): p685.
- Sukontasing, S., Tanasupawat, S., Moonmangmee, S., Lee, J.S., Suzuki, K.I. (2007). Enterococcus camelliae sp. nov., isolated from fermented tea leaves in Thailand. Int. J. Syst. Evol. Microbiol. 57: p2151–2154.
- Martinez-Murcia, A.J., Collins, M.D. (1991). Enterococcus sulfureus, a new yellow-pigmented Enterococcus species. FEMS Microbiol. Lett. 80: p69 –73.
- Van Baar, B. L. (2000). Characterisation of bacteria by matrix-assisted laser desorption/ionisation and electrospray mass spectrometry. FEMS Microbiol Rev 24(2): p193-219.
- Guidelines for drinking-water quality. World Health Organization, vierde editie, p298-299, 2011.
- Wagner, R. (1994). The regulation of ribosomal RNA synthesis and bacterial cell growth. Archives of Microbiology, Volume 161, Issue 2: p 100-109.
- Microbiology of food and animal feeding stuffs - Protocol for the validation of alternative methods. NEN-EN-ISO 16140 (2003).
- Kilb, B., Lange, B., Schaule, G., Flemming, H., Wingender, J. (2003). Contamination of drinking water by coliforms from biofilms grown on rubber-coated valves.. International Journal of Hygiene and Environmental Health. Volume 206, 6: p563-573.
- Law-Brown, J., Meyers, P.R. (2003). Enterococcus phoeniculicola sp. nov., a novel member of the enterococci isolated from the uropygial gland of the red-billed woodhoopoe, Phoeniculus purpureus. Int. J. Syst. Evol. Microbiol.53: p683– 685.