In discussies over medicijnresten en water wordt ‘de ontwikkeling van biologisch afbreekbare alternatieven’ vaak genoemd als oplossingsrichting om de emissies van milieubelastende geneesmiddelen te verminderen. Het is echter de vraag of dit leidt tot milieuwinst. Andere bronmaatregelen lijken effectiever.
Door Caroline Moermond, Bastiaan Venhuis (RIVM)
Download hier de pdf van dit artikel
Binnen de ketenaanpak ‘Medicijnresten uit Water’ [1] werken tientallen ketenpartners, van medicijnfabrikanten tot drinkwaterbedrijven, aan maatregelen die de hoeveelheid medicijnresten in water terug kunnen dringen. Deze maatregelen worden gezocht in de hele keten, van ontwikkeling, toelating, voorschrijven en gebruik tot de afvalfase. De afgelopen maanden zijn er bijvoorbeeld (pilot)projecten gestart om rioolwaterzuiveringsinstallaties (RWZI’s) te verbeteren.
Ook aan de bronkant van de ketenaanpak vinden veel verschillende initiatieven plaats. Geregeld wordt het ontwikkelen van ‘Green Pharmacy’ of ‘beter afbreekbare medicijnen’ door experts uit de waterwereld genoemd als de mogelijke oplossing. In dit artikel wordt deze claim besproken en worden voorbeelden gegeven van andere oplossingen aan de bronkant van de keten.
Wat is Green Pharmacy?
De term ‘Green Pharmacy’ kan in de praktijk een aantal verschillende dingen betekenen:
- Schonere productie. Medicijnen worden dan op een milieuvriendelijke manier geproduceerd. Er zijn dan bijvoorbeeld minder milieubelastende grondstoffen gebruikt, er worden minder oplosmiddelen gebruikt tijdens het productieproces en/of het productieproces wordt energiezuiniger gemaakt. Ook het tegengaan van lozingen van de werkzame stoffen bij productielocaties (vaak in Aziatische landen) hoort hierbij. Industriële partijen gebruiken deze term vaak om aan te geven dat ze in de hele productieketen duurzame maatregelen hebben genomen, zoals minder gebruik van energie, oplosmiddelen en grondstoffen. Dit betekent echter niét, dat er ook ‘groenere’ werkzame stoffen gebruikt worden.
- Efficiëntere toediening; precision medicine. De keuze voor een geneesmiddel en een dosering wordt volledig toegesneden op de individuele patiënt. Zo kan bijvoorbeeld op basis van informatie over een individuele patiënt uit genotypering en andere technieken het meest geschikte geneesmiddel voor die betreffende patiënt worden bepaald. Dat vermindert in de praktijk het aantal verschillende medicijnen dat moet worden uitgeprobeerd. Hiermee wordt ook voorkomen dat patiënten alleen maar last krijgen van de bijwerkingen zonder profijt te hebben van het bedoelde therapeutische effect. Precision medicine betekent overigens niet dat de dosering omlaag gaat, maar dat er een gerichtere en daarmee effectievere therapie wordt ingezet waar het onnodig medicijngebruik naar beneden wordt gedrongen.
- Efficiëntere toediening; targeted drug delivery. De toediening en/of formulering van de werkzame stof van een geneesmiddel wordt zo ontwikkeld dat deze alleen terecht komt bij de ‘target’ (de chemische receptor, bijvoorbeeld een enzymsysteem, of het zieke weefsel). Hierdoor wordt alleen de te behandelen target aan een voldoende hoge concentratie aan medicijn blootgesteld en de gezonde cellen niet. Dit vermindert bijwerkingen. Een gerichtere toediening leidt over het algemeen tot een verlaging van de eerder gehanteerde dosis. Uitzonderingen zijn bijvoorbeeld gels die slecht door de huid worden opgenomen, waardoor een deel wel bij de beoogde target terecht komt (bijvoorbeeld het handgewricht), maar de grootste hoeveelheid van het toegepaste product in het milieu belandt. Targeted drug delivery moet in een gunstige verhouding staan tot de belasting van de patiënt; het ligt bijvoorbeeld niet voor de hand om bij gewone hoofdpijn paracetamol te injecteren.
- Beter afbreekbare werkzame stoffen. Bij de ontwerpfase van een geneesmiddel worden eisen gesteld aan de veiligheid voor de mens en het milieu (safe by design); zie onder andere [2]. Een eis kan zijn dat een werkzame stof gemakkelijk door de RWZI of in het milieu wordt afgebroken tot onschadelijke afbraakproducten. Dit principe wordt al toegepast op chemische stoffen.
Het ontwikkelen van groenere productiemethodes en efficiëntere toedieningsmethodes krijgt momenteel veel aandacht, ook binnen de farmaceutische sector. Het ontwikkelen van beter afbreekbare werkzame stoffen wordt in de milieusector vaak genoemd, maar hier kleven veel haken en ogen aan. Dit artikel gaat hier verder op in.
- Zijn beter afbreekbare werkzame stoffen wenselijk?
Bij het ontwikkelen van medicijnen wordt in eerste instantie gekeken naar het therapeutisch effect (de werkzaamheid) en de belasting van de patiënt (bijvoorbeeld door bijwerkingen). Daarnaast speelt de verwachte economische rentabiliteit een rol: de ontwikkelkosten van een medicijn moeten terugverdiend kunnen worden. De ontwikkeling van een medicijn begint meestal met het identificeren van een aandoening waar nog geen behandeling voor is, of waarvoor bestaande behandelingen verbeterd kunnen worden. Vervolgens begint een uitgebreid chemisch, farmacologisch en toxicologisch onderzoek in het laboratorium. Het is een omvangrijk selectieproces waarbij vele gelijksoortige moleculen worden bedacht, gemaakt en getest.
Omdat kleine variaties in een molecuulstructuur een grote invloed kunnen hebben op de geschiktheid, vallen vaak duizenden nieuwe werkzame stoffen af tijdens het proces van drug discovery en de preklinische fase van het ontwikkeltraject Alleen de meest veelbelovende nieuwe werkzame stof wordt uiteindelijk op de mens getest. Uit deze klinische studies moet vervolgens blijken of verdere ontwikkeling therapeutisch en economisch nog steeds zinvol blijft. Een nieuw geneesmiddel maakt alleen kans op registratie als het wat toevoegt aan de bestaande behandelingen.
In het ontwikkeltraject van een werkzame stof is er een moment waarop een basismolecuul wordt vastgesteld dat essentieel is voor het mechanistisch effect. Vanaf dat moment wordt de molecuulstructuur gevarieerd voor een optimale werking in het lichaam en minimalisering van ongewenste effecten. Voor een optimale therapeutische werking van een werkzame stof is een bepaalde concentratie in het bloed vereist.
Het menselijk lichaam beschikt echter over mechanismen die ervoor zorgen dat stoffen, waaronder medicijnen, zo snel mogelijk worden afgebroken of uitgescheiden. Een nieuwe werkzame stof heeft alleen therapeutisch nut als deze de target (het te behandelen weefsel of de receptor) in voldoende mate kan bereiken en het beoogde therapeutische effect lang genoeg kan aanhouden. De beschikbaarheid wordt bepaald door de mate en snelheid van opname, verdeling over het lichaam, afbraak en uitscheiding.
Het overwegen van de afbreekbaarheid in het milieu betekent een extra selectiestap in het ontwikkeltraject van een werkzame stof. Daarbij mag deze afbreekbaarheid niet ten koste gaan van de werkzaamheid van het geneesmiddel. Dat geldt zowel voor nieuwe werkzame stoffen als voor alternatieven voor bestaande, milieubelastende geneesmiddelen. Milieubelastende geneesmiddelen zijn doorgaans generieke geneesmiddelen (waarvan het patent al geruime tijd verlopen is) met een lange staat van dienst.
Wil men deze vervangen door een minder milieubelastende werkzame stof, dan wordt het een probleem wanneer de beter afbreekbare stof minder effectief is in het lichaam van de patiënt, waardoor hogere doseringen nodig zijn. Hogere en/of meer doseringen verhogen de belasting van de patiënt (bijwerkingen) en onpraktische doseerschema’s ondermijnen therapietrouw. Hogere dagdoseringen betekenen ook een grotere vracht aan medicijnresten (werkzame stoffen en hun metabolieten, afbraakproducten) voor de RWZI. Een vervangend geneesmiddel moet beter scoren op de baten, de risico’s en/of op kosteneffectiviteit dan het bestaande middel. Wanneer vaker of hoger gedoseerd moet worden, is dit vaak niet het geval.
Vergelijkend onderzoek
Hieronder wordt de keuze tussen twee werkzame stoffen nader uitgewerkt in een denkbeeldig voorbeeld. Er zijn bijvoorbeeld de fictieve werkzame stoffen Q1 en Q2 die een vergelijkbaar mechanistisch effect hebben op een enzym in de hersenen. De aanwezigheid van de hydroxy-groep in Q2 zorgt voor een betere afbraak in het milieu. Uit vergelijkend klinisch onderzoek blijkt vervolgens dat de opname en distributie vergelijkbaar zijn, maar dat Q2 vanwege de hydroxy-groep een wat kortere halfwaardetijd heeft in het bloed. Om een stabiele bloedconcentratie te krijgen die hoog genoeg is om therapeutisch effect te hebben, dient de patiënt tweemaal daags een tablet van 10 mg Q1 in te nemen.
Afbeelding 1A laat zien hoe de concentratie van Q1 in het bloed in de loop van de tijd verloopt. Na ongeveer 12 uur is deze bloedconcentratie gezakt onder de gewenste therapeutische concentratie en is een nieuwe dosis nodig. Voor Q2 is bij de modellering uitgegaan van een halfwaardetijd (voor uitscheiding en metabolisatie) van 7 uur in plaats van de voor Q1 gebruikte 10 uur. Afbeelding 1B laat zien dat tweemaal daags een Q2-tablet van 10 mg daardoor een lagere maximumconcentratie in het bloed geeft en bovendien de gewenste therapeutische concentratie minder lang bereikt.
Om voor Q2 dezelfde gewense minimale bloedconcentratie te bereiken, zal er dus vaker (afbeelding 1C) of hoger (afbeelding 1D) gedoseerd moeten worden. In totaal moet dan per dag in plaats van 200 mg werkzame stof, 340 mg (bij een hogere dosering; afbeelding 1C) of 300 mg (bij vaker doseren; afbeelding 1D) worden ingenomen om de gewenste concentratie te bereiken. Als Q2 verder geen duidelijke therapeutische voordelen biedt (minder bijwerkingen, andere indicatie) dan ligt de keus om deze werkzame stof verder te ontwikkelen niet voor de hand.
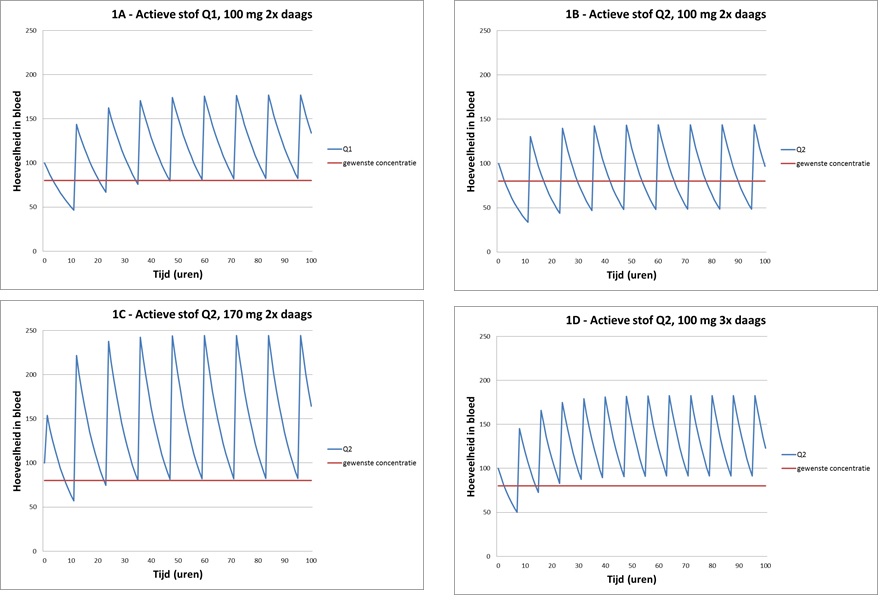
Afbeelding 1. Gesimuleerde hoeveelheden in bloed van het fictieve medicijn Q1 en de beter afbreekbare variant Q2. Voor Q1 is een halfwaardetijd van 10 uur gebruikt, voor Q2 is dat 7 uur. Beide werkzame stoffen volgen hier een simpel afbraakmodel
Bij een toename van de dagdosering van 200 naar 300 of 340 mg neemt ook de hoeveelheid uitgescheiden metabolieten (afbraakproducten) toe. Wanneer deze metabolieten in een RWZI mineraliseren (volledig afbreken tot kleine moleculen), zijn ze daarmee onschadelijk gemaakt. Niet alle metabolieten en werkzame stoffen worden echter volledig in de RWZI afgebroken. Dat betekent dat bij een hogere dosering waarschijnlijk ook meer medicijnresten (werkzame stof en verschillende metabolieten) in het milieu terecht komen.
Daarnaast zijn sommige metabolieten zogeheten ‘conjugaten’ van de moederstof, de oorspronkelijke werkzame stof. Deze conjugaten kunnen in een RWZI weer omgezet worden in de oorspronkelijk werkzame stof. Een voorbeeld daarvan is het vrijkomen van naproxen uit naproxen-conjugaten. Afhankelijk van de conjugaten die de patiënt uitscheidt moet men dus ook rekening houden met terugvorming van de werkzame stof in de RWZI en emissie naar het oppervlaktewater.
Is het technisch haalbaar om beter afbreekbare medicijnen te ontwikkelen?
In de wetenschappelijke literatuur [2], [3] worden enkele voorbeelden beschreven van beter afbreekbare werkzame stoffen. Het zijn varianten op bestaande werkzame geneesmiddelen door kleine chemische modificaties. Beter afbreekbare werkzame stoffen kunnen dus in specifieke gevallen wel ontworpen worden, maar moeten dan naast hun afbreekbaarheid in het milieu ook getest worden op effectiviteit/werkzaamheid en veiligheid, waarna een nieuwe baten/risico-afweging plaatsvindt.
De grote vraag blijft wanneer een ontwikkeltraject ecotoxicologisch wenselijk én tegelijkertijd therapeutisch haalbaar is. De meeste medicijnen met een milieurisico [4], zijn al lang op de markt en hebben een gevestigde reputatie waar patiënten en artsen aan gewend zijn. Zelfs al zou Q2 uit het voorbeeld markttoelating verkrijgen dan betekent dit niet automatisch dat het daadwerkelijk ook Q1 gaat vervangen. Hiermee ligt de lat voor het succesvol ontwerpen, ontwikkelen en lanceren van beter afbreekbare werkzame stoffen in de meeste gevallen waarschijnlijk te hoog.
Wanneer kunnen beter afbreekbare werkzame stoffen wél nuttig zijn?
Voor compleet nieuwe geneesmiddelen, die niet dienen ter vervanging van een ander middel, kan het nuttig zijn om al vroeg in het ontwikkelproces de mogelijke milieueffecten mee te nemen. Het is denkbaar dat er middelen te ontwerpen zijn die wél afbreken in de RWZI (bijvoorbeeld door omzetting door bacteriën), maar niet in het menselijk lichaam. Ook is het voor sommige middelen, zoals röntgencontrastmiddelen, geen probleem als het middel sneller afbreekt in de patiënt. Daarom werkt de industrie aan een methode om al vroeg in het ontwikkelproces rekening te houden met mogelijke milieuproblemen, inclusief een methodiek om deze mee te kunnen nemen in de kosten/batenafweging [4], [5].
Kunnen schadelijke medicijnen vervangen worden door andere medicijnen?
Een van de uitgangspunten van de ketenaanpak ‘Medicijnresten uit Water’ is dat er pragmatisch wordt gewerkt en alleen ‘echte’ problemen worden opgelost. Dat betekent dat het op voorhand duidelijk moet zijn dat een vervangend geneesmiddel als het fictieve Q2 beter is voor het milieu én niet nadelig voor de patiënt. Bovendien moeten de kosten maatschappelijk aanvaardbaar zijn.
Hogere kosten van een nieuw, beter afbreekbaar medicijn zullen door de maatschappij gedragen moeten worden. De vraag is dan voor welke van de circa 2.000 in Nederland toegelaten werkzame stoffen de keuze gemaakt wordt om een beter afbreekbaar alternatief te ontwikkelen. Een voorbeeldstof waarvoor een beter afbreekbaar alternatief is gepubliceerd [3], propranolol, vormt individueel geen milieurisico. Het vervangen van dit geneesmiddel is dus geen oplossing voor de aanwezigheid van honderden verschillende medicijnresten in het oppervlaktewater.
Een ander voorbeeld is het vervangen van prednison door berberine [6]. Ten eerste is prednison geen stof met een milieurisico bij het huidige gebruik. Ten tweede zijn deze stoffen niet uitwisselbaar qua werkingsprofiel en bijwerkingen. En ten slotte is er het probleem dat berberine verdacht carcinogeen is. Daarmee is de acceptatie van berberine als vervanger van prednison erg onwaarschijnlijk.
Het RIVM heeft in 2017 onderzocht of er mogelijkheden zijn om medicijnen te vervangen door behandelingen die het milieu minder belasten [7]. Daartoe zijn gesprekken gevoerd met vertegenwoordigers van professionals uit de medicijnketen, zowel beleidsmakers, fabrikanten, beoordelaars, zorgverleners, apothekers als waterzuiveraars. Alle geïnterviewden toonden zich bereid na te denken over het vervangen van behandelingen maar benadrukten dat het belang van de patiënt bovenaan staat.
De behandeling van de patiënt mag er niet op achteruit gaan, wat betekent dat het vervangende middel minstens even effectief en veilig moet zijn. Bovendien moet de milieuwinst van het vervangende middel zijn onderbouwd. Het vervangen van middelen waarvan onbekend is of ze het milieu belasten, is niet in het belang van de patiënt. Voor veel geneesmiddelen ontbreken echter goede gegevens over de effecten op het milieu. In de praktijk bleek het onmogelijk om combinaties te vinden die aan de vereisten voldeden.
Welke bronaanpakopties kunnen wel succesvol zijn?
In de ketenaanpak ‘Medicijnresten uit Water’ wordt gewerkt aan maatregelen in de hele keten, zowel end-of-pipe (aanpassingen aan RWZI’s), als aan de bron. Een aantal van de bronmaatregelen kan zorgen voor een vermindering van de hoeveelheid medicijnresten, andere richten zich vooral op kennisuitwisseling en bewustwording.
Voorbeelden hiervan zijn (niet uitputtend):
- Efficiëntere toedieningsmethodes, zoals Precision medicine en Targeted drug delivery (hierboven besproken onder ‘Wat is Green Pharmacy?’)
- Vervanging van röntgencontrastmiddelen door andere middelen, of het opvangen van röntgencontrastmiddelen in plaszakken.
- Voorlichten van personeel in zorginstellingen over correcte omgang met medicijnresten als onderdeel van de Green Deal Duurzame zorg [8].
- Programma om het gebruik van psychofarmaca te verminderen, ook als onderdeel van de Green Deal Duurzame zorg.
- Voorlichting aan artsen en verpleegkundigen over het niet wegspoelen van vloeibare medicijnresten.
- Een module over milieueffecten van medicijnen toevoegen aan het bijscholingscurriculum van artsen.
- Openbaar maken van milieugegevens van medicijnen door de Europese farmaceutische industrie, zodat waterbeheerders deze gegevens eenvoudig kunnen vinden en gebruiken. Hieraan wordt gewerkt in het huidige iPiE-project [4], dat een vervolg krijgt in een nieuw programma gefinancierd door de Europese Commissie als de farmaceutische industrie [5].
Daarnaast zijn de andere onderdelen van Green Pharmacy, zoals hierboven beschreven (groenere productiemethodes en efficiëntere toepassing) veelbelovend.
Conclusies
Het ontwikkelen van beter afbreekbare werkzame stoffen is geen algemene oplossingsrichting voor de milieuproblemen van de huidige medicijnresten. De lat voor de toelating van nieuwe geneesmiddelen ligt erg hoog. Het blijft de vraag of vervangende werkzame stoffen wel medicijnen opleveren met voldoende toegevoegde waarde voor de patiënt.
Daarnaast wordt ook de milieuwinst beperkt wanneer patiënten van een vervangende werkzame stof meer moeten innemen omdat deze bijvoorbeeld sneller afbreekt. Er komen dan uiteindelijk méér medicijnresten in het afvalwater. Mocht er toch een geschikte werkzame stof worden gevonden dan duurt het nog jaren voordat deze als medicijn op de markt kan worden toegelaten. Andere bronmaatregelen, zoals efficiëntere toedieningsmethodes en preventieprogramma’s, lijken daarom effectiever.
REFERENTIES
1. Ketenaanpak ‘Medicijnresten uit water’. https://jamdots.nl/view/239/medicijnresten-uit-water
2. Kümmerer, K., Dionysiou, D.D., Olsson, O., Fatta-Kassinos, D. (2018). A path to clean water. Science 361: 222-224.
3. Rastogi, T., Leder, C., Kümmerer, K. (2015). Re-designing of existing pharmaceuticals for environmental biodegradability: A tiered approach with β-blocker propranolol as an example. Environ Sci Technol 49: 11756-11763.
4. Intelligence-led assessment of pharmaceuticals in the environment (i-pie); http://i-pie.org/
5. Innovative Medicines Initiative (IMI); https://www.imi.europa.eu/apply-funding/open-calls/imi2-call-17
6. Moermond, C.T.A. et al. (2016). Geneesmiddelen en waterkwaliteit. RIVM rapportnummer 2016-0111. RIVM, Bilthoven.
7. Allijn, I.E., Oldenkamp, R., Storm, G., Ragas, A.M.J., Schiffelers, R.M. (2018). Environmental impact of switching from the synthetic glucocorticoid prednisolone to the natural alkaloid berberine. PLoS ONE 13(6)e0199095.
8. Grinten, E. van der et al. (2017). Milieuafwegingen in de geneesmiddelvoorziening. RIVM rapportnummer 2016-0207. RIVM, Bilthoven.
9. Green Deal Duurzame zorg. https://milieuplatformzorg.nl/green-deal/
