Download hier een pdf van dit artikel.
Blauwalgen (of cyanobacteriën) zijn alom bekend omdat ze een gezondheidsrisico kunnen vormen voor mens en dier. Diverse blauwalgensoorten zijn namelijk in staat gifstoffen te produceren. Als de temperatuur toeneemt en menig waterrecreant en/of hond het water opzoekt voor verkoeling kan het plezier worden verpest door hoge concentraties blauwalgen. Verhoogde watertemperatuur, stagnant water en voedselrijke omstandigheden maken dat de dichtheid van blauwalgen sterk kan toenemen. Bovendien kunnen omvangrijke drijflagen gevormd worden met een kenmerkende (blauw)groene kleur.
De vorming van gifstoffen is een complexe zaak. Niet elke soort blauwalg produceert gifstoffen, en de productie kan zelfs op stam(ondersoort)niveau verschillen. Bovendien zijn blauwalgen in staat om een breed scala aan verschillende gifstoffen te produceren.
In het Blauwalgenprotocol [1] zijn richtlijnen opgenomen hoe zwemwaterbeheerders om moeten gaan met zwemwaterlocaties waarin bloei van blauwalgen en vorming van drijflagen kan plaatsvinden. De belangrijkste criteria voor het beoordelen van de risico’s zijn de eventuele aanwezigheid van drijflagen en de concentratie van de potentieel toxische blauwalgen (uitgedrukt in o.a. het biovolume). Het totale biovolume van een blauwalgengeslacht in een watermonster wordt bepaald aan de hand van een microscopische telling vermenigvuldigd met het gemiddelde biovolume van enkele cellen (minimaal 20) behorend bij een bepaald geslacht en/of bepaalde soort.
Om de veiligheid van de waterrecreant te waarborgen en de mogelijke blootstelling aan gifstoffen zoveel mogelijk te beperken, wordt het zwemwater tijdens het zwemseizoen zeer regelmatig gecontroleerd op blauwalgen. Dit gebeurt door middel van visuele inspecties, zo nodig gevolgd door tweewekelijkse monstername. Over het algemeen vindt kwantificatie van blauwalgen nog plaats met behulp van microscopische analyse. Dit is niet eenvoudig, want de morfologische verscheidenheid van blauwalgen is enorm. Er is dan ook veel kennis en ervaring nodig om blauwalgen onder een microscoop te herkennen en te kwantificeren. Daar komt nog bij dat de uitkomst van de analyse van verschillende laboratoria kan variëren, bijvoorbeeld door het gebruik van verschillende telmethoden [2]. DNA-detectie is voor routinematige analyse van potentieel toxische blauwalgen een goed alternatief.
DNA detectie van blauwalgen
Met de kwantitatieve DNA-techniek qPCR (quantitative polymerase chain reaction) zijn de meest voorkomende potentieel toxineproducerende blauwalgen te detecteren [3] (zie kader). Daarvoor heeft KWR sinds 2009 specifieke merkers ontwikkeld voor de vier meest voorkomende geslachten: Microcystis, Planktothrix, Anabaena en Aphanizomenon. De methode richt zich op het fycocyanine-gen dat in alle blauwalgen aanwezig is [3]. Fycocyanine is een pigment dat, een typische cyaanblauwe kleur heeft. Deze kleur wordt goed zichtbaar als de cellen afsterven en openbreken. Koppeling van de kwantitatieve resultaten van de microscopische analyses aan de DNA-analyseresultaten geeft nauwkeurige conversiefactoren voor het omrekenen van de qPCR-resultaten in celequivalenten. De dynamiek van de blauwalgenpopulaties in een zwemwater bleek met tellingen en met de DNA-techniek vergelijkbare trends te vertonen (afbeelding 1).
In het Blauwalgenprotocol wordt echter gesproken van vijf potentieel toxische blauwalgen geslachten; naast de hierboven genoemde vier genera wordt ook het geslacht Woronichinia expliciet genoemd. Het compleet maken van de qPCR-toolbox met een merker voor dit geslacht zou de brede toepassing van de DNA-techniek bevorderen.

Afbeelding 1. Analyseresultaten van microscopische tellingen en qPCR van een locatie langs het IJsselmeer (2013). De lijnen zijn de telresultaten, de onderbroken lijnen de qPCR-resultaten.
Ontwikkeling DNA detectiemethode Woronichinia
In 2013 is KWR in het kader van een TKI-regeling (Topconsortia Kennis en Innovatie) een samenwerkingsverband aangegaan met Intertek Life Sciences in Geleen. Doel van de samenwerking was om voor het geslacht Woronichinia een nieuwe qPCR methode te ontwikkelen. Aansluitend doel was om de reeds beschikbare qPCR methoden voor de vier geslachten blauwalgen te valoriseren, en ze daardoor beschikbaar en toepasbaar te maken voor brede, routinematige, analyse.

Woronichinia
Naast de vier genoemde geslachten worden in oppervlaktewateren – veelal stadswateren, incidenteel ook zwemwaterlocaties – ook cellen van het geslacht Woronichinia aangetoond. Cellen van dit geslacht blijken eveneens in staat om gifstoffen (microcystine) te produceren. Voor Woronichinia was er nog geen DNA-detectietechniek beschikbaar, cellen konden alleen met microscopische analyse worden opgespoord en gekwantificeerd.
Anders dan van de geslachten Microcystis, Planktothrix, Anabaena en Aphanizomenon was van het geslacht Woronichinia vrijwel geen genetische informatie beschikbaar in de publieke DNA-databanken. Woronichinia blijkt vrijwel niet kweekbaar onder laboratoriumcondities en is dan ook logischerwijs in geen enkele (internationale) cultuurcollectie aanwezig. De enige mogelijk-heid om DNA-informatie te verkrijgen, noodzakelijk voor het ontwerp van de specifieke qPCR-primers en -probe, is in het veld op zoek te gaan naar Woronichinia. In 2013 zijn op verschillende locaties waar gedurende het jaar Woronichinia is waargenomen, watermonsters verzameld en microscopisch geanalyseerd. In verschillende monsters bleken de typische Woronichinia kolonies aanwezig te zijn (afbeelding 2).

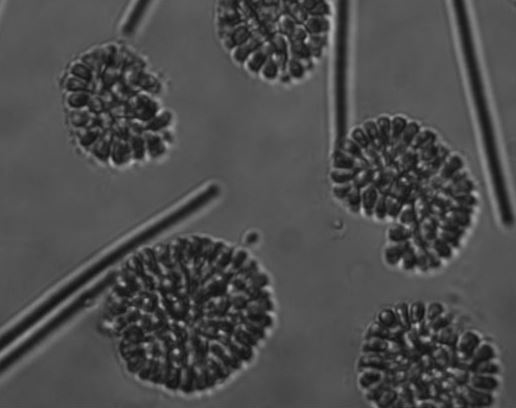
Afbeelding 2. Drijflaag in stadswater in Tilburg (links) en corresponderend microscopisch plaatje met ronde kolonies van Woronichinia-cellen (rechts)
Met behulp van een capillair zijn circa 90 Woronichinia kolonies geselecteerd en is van deze cellen het DNA geëxtraheerd waarmee vervolgens de DNA-volgorde van het fycocyanine gen is geanalyseerd. De unieke DNA-volgorde van dit gen is de basis voor het ontwerp van specifieke primers en de probe voor de qPCR methodiek.
De ontwikkelde methode is geoptimaliseerd, gevalideerd en vervolgens toegepast op DNA-extracten van zwemwatermonsters. Van deze monsters zijn ook de microscopische analysedata beschikbaar. In tabel 1 zijn de resultaten samengevat van de watermonsters waar met één of beide analysemethoden Woronichinia is aangetoond. Wat opvalt is dat in acht van de negen watermonsters het detectieresultaat goed overeenkomt, waarbij de kwantitatieve waardes slechts enigszins verschillen. Deze relatief kleine verschillen zijn te verklaren door
homogeniteitsverschillen tussen de monsters en variatie van met name de microscopische tellingen.
In watermonster A zijn met de qPCR-methode Woronichinia en ook Aphanizomenon aangetoond, maar niet met de telling. Dit is mogelijk het gevolg van de relatief lage concen-tratie, waardoor de cellen van de twee geslachten in de microscopische telling niet zijn waar-genomen. In watermonster C zijn mogelijk in de microscopische analyses Woronichinia en Microcystis verward of foutief geïdentificeerd.
Tabel 1. Resultaten microscopische analyse en DNA-analyse (qPCR) zwemwatermonsters

Op basis van geanalyseerde watermonsters kan worden geconcludeerd dat de qPCR-methode voor detectie van Woronichinia naar behoren werkt. De merker lijkt net als de andere merkers specifiek, selectief, kwantitatief en gevoelig. Voor routinematige toepassing bij de analyse van zwemwatermonsters is het verder vergelijken van analyseresultaten met microscopische tellingen en met qPCR voor Woronichinia nog essentieel: ook voor Woronichinia is een nauwkeurige conversiefactor nodig waarmee de qPCR-resultaten kunnen worden omgezet in celequivalenten.
Implementatie van qPCR-techniek
Binnen het TKI-project heeft Intertek de reeds beschikbare qPCR-techniek voor de vier geslachten blauwalgen in het laboratorium geïmplementeerd. Zodoende komt de methode beschikbaar voor ruimere toepassing in het zwemwaterbeheer. Intertek heeft in 2013 de qPCR-methodiek toegepast op 306 zwemwatermonsters, afkomstig van ruim 30 zwemwaterlocaties verspreid over het land. Vergelijking van de resultaten met die van microscopische tellingen laat zien dat in 2013 de resultaten data opleveren die wat betreft dynamiek vergelijkbaar zijn. Voor elk geslacht zijn in 2013 positieve significante (p < 0,01) correlatiecoëfficiënten aangetoond [4].
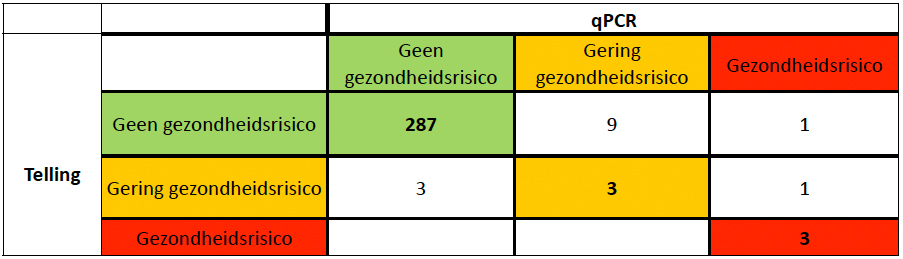
Aansluitend blijkt dat de data van beide methoden in het kader van het Blauwalgenprotocol over het algemeen leiden tot eenzelfde beslissing (tabel 2). In 95,5% van de monsters (293 van de 306) wordt er een gelijke beslissing genomen. In 11 gevallen werden de zwemlocaties op basis van de DNA-analyse in een hogere risicocategorie ingedeeld. Bij 9 monsters bleek de DNA-analyse reden om een waarschuwing af te geven terwijl er op basis van de telling geen actie ondernomen zou worden. Bovendien werd op basis van één monster een negatief zwemadvies gegeven terwijl er op basis van de telling geen actie nodig was, en moest bij één ander monster een negatief zwemadvies worden gegeven, terwijl de telling wees op een waarschuwing. Andersom bleken er in drie gevallen op basis van de telling waarschuwingen nodig, terwijl er volgens de DNA-analyse geen actie nodig was.
Tabel 2. Vergelijking van kwaliteitsklasse-indeling van de watermonsters volgens het Blauwalgenprotocol, wanneer de concentraties blauwalgen van de vier potentieel toxische genera zijn bepaald met microscopische tellingen of met de qPCR-methode [1].
Conclusies
Behalve voor de vier meest voorkomende potentieel toxische blauwalgen (Microcystis, Planktothrix, Anabaena en Aphanizomenon) is er nu ook een DNA-merker beschikbaar voor het geslacht Woronichinia, dat veelvuldig in stadswateren en incidenteel ook in zwemwaterlocaties tot bloei komt. De resultaten van de veldstudies laten zien dat de DNA-toolbox blauwalgen klaar is voor routinematige toepassing bij het monitoren van (potentieel) toxische blauwalgen in zwemwater. De qPCR-methode, inclusief alle standaarden en controles, is zeer robuust en gebruiksvriendelijk. Intertek heeft aangetoond dat de methode met goed resultaat op zeer korte termijn kan worden geïmplementeerd in het laboratorium. Een veldstudie van 306 zwemwatermonsters waarin zowel met qPCR als met celtellingen de blauwalgconcetraties zijn bepaald, laat zien dat het resultaat voor 95,5% van de veldmonsters een gelijke risico-beoordeling oplevert.
Dit project is mede gefinancierd uit de Toeslag voor Topconsortia voor Kennis en Innovatie (TKI's) van het ministerie van Economische Zaken.
Literatuur
1. Anonymus, Blauwalgenprotocol 2012 (2012), aangepaste versie van het blauwalgenprotocol 2011.
2. Wullings, B., Linde, D. van der, & Kardinaal, E. (2009). Ontwikkeling van qPCR methoden voor de kwantitatieve detectie van de verschillende toxineproducerende cyanobacteriën. KWR 09.089.
3. Kardinaal, E., Wullings, B., Zaan, B. van der, & Dionisio Pires, M. (2013). Blauwalgen- en toxinegenen snel gedetecteerd. H2O online.
4. Learbuch, K. and E. Kardinaal (2014). Vergelijk tellingen en qPCR analyse van cyanobacteriën. KWR 2014.004.


















