In de met Maaswater gevoede spaarbekkens in de Biesbosch komen sinds enkele jaren de invasieve Quaggamossel en Zwartbekgrondel voor. Uit een analyse van het voedselweb blijkt de Quaggamossel minder van belang te zijn als voedselbron voor de Zwartbekgrondel dan vaak wordt aangenomen.
Geschreven door Yvon Verstijnen, Esther Lucassen, Fons Smolders (Onderzoekcentrum B-WARE), Arco Wagenvoort (AqWa ecologisch advies), Henk Ketelaars (Evides Waterbedrijf)
Download hier de pdf van dit artikel
Voor het behoud en beheer van ecosystemen is het cruciaal om de structuur en het functioneren van het voedselweb te begrijpen. Een voedselweb geeft weer welke soorten in het systeem voorkomen en hoe deze zich tot elkaar verhouden (‘wie eet wie?’). De algehele soortengemeenschap en de interacties tussen deze soorten, zoals prooi-predatorrelaties, worden dan ook vaak onderzocht. Invasieve soorten kunnen direct (bijvoorbeeld via competitie om voedsel) of indirect (bijvoorbeeld door het beïnvloeden van abiotische factoren) veranderingen binnen een voedselweb teweeg brengen [1]. Abiotische factoren zijn milieufactoren zonder biologische oorsprong, zoals temperatuur, grondsoort en stroming.
Soorten die het milieu waarin ze voorkomen en daarmee de ecologische relaties, de biodiversiteit en de abiotische situatie in sterke mate kunnen veranderen, worden ook wel biobouwers of ecosysteemingenieurs genoemd. Het is bekend dat mosselen vanwege deze eigenschap een prominente plaats in een voedselweb kunnen innemen.
Door de komst van exoten kunnen nieuwe trofische relaties (relatie tussen verschillende schakels uit een voedselketen) ontstaan en kunnen bottom-up- of top-downrelaties veranderen. Om de trofische structuur te ontrafelen en inzicht te krijgen in de energiestromen binnen een ecosysteem kunnen stabiele-isotopenanalyses een uitkomst bieden. Hiervoor worden vaak stikstof-(N)- en koolstof- (C-)isotopen gebruikt.
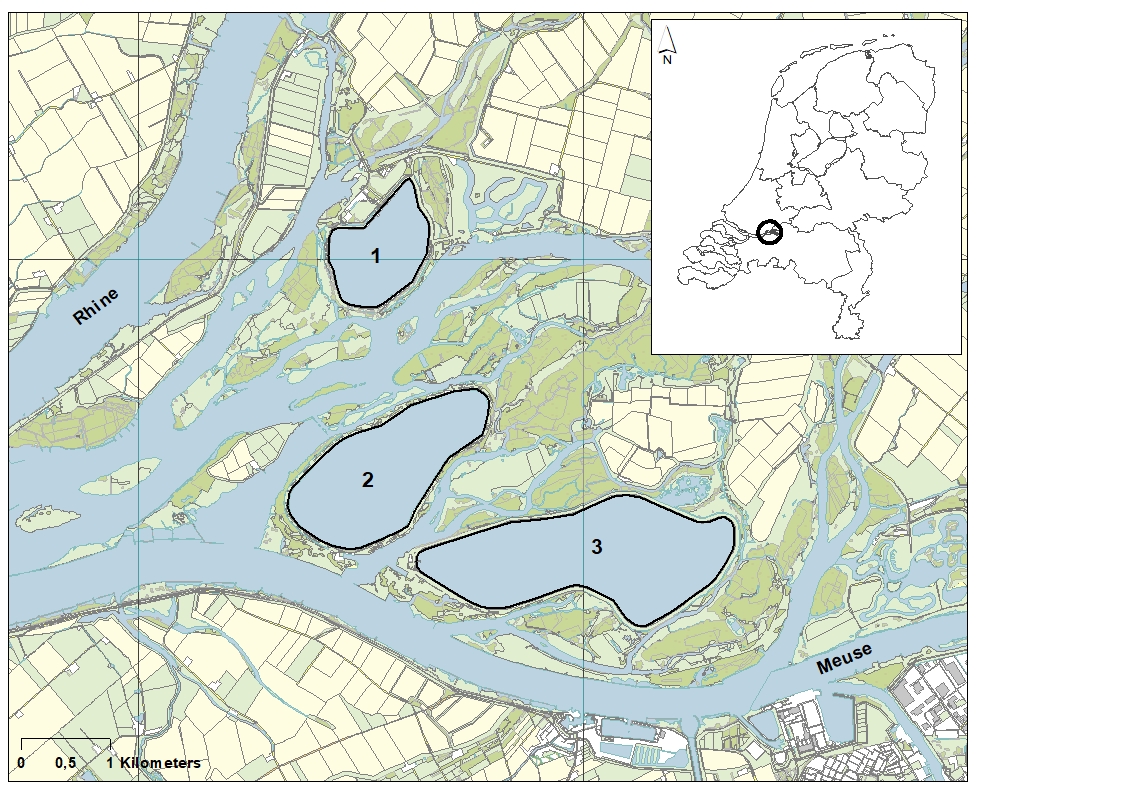
Afbeelding 1. De drie met Maaswater gevoede spaarbekkens in de Brabantse Biesbosch. 1: Petrusplaat, 2: Honderd en Dertig, 3: De Gijster
In de drie Biesboschspaarbekkens De Gijster, Petrusplaat en Honderd en Dertig (zie afbeelding 1) komen zowel de Quaggamossel (Dreissena rostriformis bugensis) als de Zwartbekgrondel (Neogobius melanostomus) voor (zie afbeelding 2) [1]. De soorten komen oorspronkelijk uit het gebied rond de Zwarte en Kaspische Zee en hebben zich op verschillende wijzen buiten dit gebied verspreid [2]. De Quaggamossel heeft in veel wateren een voorgaande exoot, de Driehoeksmossel (Dreissena polymorpha), vervangen.
Toename van het aantal filtrerende mosselen leidt meestal tot een afname van chlorofyl-α (als maat voor algenbiomassa) en een toename van het doorzicht van het water. Daarnaast verandert het benthische habitat (habitat op de bodem van het waterlichaam) door de vorming van uitgestrekte mosselbanken. Van zwartbekgrondels is bekend dat ze quaggamosselen eten [3] en inheemse vispopulaties kunnen beïnvloeden [4].

Afbeelding 2. Zwartbekgrondels op een mosselbank. ©BlikOnderWater
Onderzoek
De spaarbekkens in de Biesbosch zijn kunstmatige reservoirs die onderling gekoppeld zijn en in serie doorstroomd worden. Ze verschillen in oppervlakte (100-300 hectare) en diepte (maximaal 15 tot 31 meter). De bekkens kennen geen stratificatie van de waterkolom in de zomer, aangezien het water in de zomermaanden wordt gemengd door beluchters.
De bekkens zijn in de jaren ’70 van de vorige eeuw aangelegd om Maaswater op te slaan ten behoeve van de drinkwatervoorziening in zuidwest-Nederland. Tijdens de gemiddelde verblijftijd van vijf maanden zorgen natuurlijke processen voor een aanzienlijke verbetering van de waterkwaliteit. Het is dan ook belangrijk om veranderingen in het voedselweb te monitoren om eventuele risico’s voor de beoogde waterkwaliteitsverbeteringen in te kunnen schatten [5].
Het doel van het huidige onderzoek was het inzichtelijk maken van het effect van de recente invasie door de Quaggamossel en Zwartbekgrondel op de trofische relaties en de soortensamenstelling in de bekkens. Hiervoor is gebruik gemaakt van stabiele-isotopenanalyse (zie kader) en monitoringsdata.
Stabiele-isotopenanalyse
|
In 2016 werden op diverse locaties in de drie bekkens monsters genomen van de meest voorkomende en/of potentieel belangrijke organismen (zie [1] voor details). Kort samengevat werden monsters genomen van algen, cyanobacteriën (blauwalg), waterplanten, zoöplankton, macro-invertebraten (ongewervelde diertjes), mosselen en vissen. Van de monsters werden stabiele-isotopenratio’s voor stikstof en koolstof (δ15N en δ13C) gemeten, uitgedrukt in ‰.
Vervolgens zijn de relatieve bijdragen van enkele voedselbronnen bepaald met een model (SIAR) in R Statistics. Dit gebeurde op basis van de stabiele isotopen van de voedselbronnen en consumenten (hier voor de uitheemse Zwartbekgrondel en inheemse Pos). Tevens werden monitoringsdata verzameld van vissen (1998 - 2016) en macro-invertebraten (2002 - 2017) om inzicht te krijgen in trends voor de aantallen per soort [1].
RESULTATEN
Structuur van het voedselweb
Wanneer de resultaten van de N- en C-isotopen tegen elkaar worden uitgezet wordt de plaats in het voedselweb van de organismen ten opzichte van elkaar zichtbaar. Hoe ‘hoger’ in de figuur, hoe ‘hoger’ de positie in het voedselweb. In afbeelding 4 zijn de gemiddelde δ15N en δ13C van de onderzochte soorten in de spaarbekkens weergegeven.

Afbeelding 4. De stabiele isotopen van diverse organismen. 1, 2, 3=grove clustering van groepen
Aan de basis van het voedselweb kunnen twee groepen van primaire producenten worden onderscheiden. De pelagische algen (levend in de waterkolom, dus niet nabij de bodem) in cluster 1 vormen de eerste groep en hebben een δ13C-signatuur van gemiddeld (±SD) –30,0 ± 2,4‰ en δ15N-signatuur van 5,3 ± 2,9‰. De andere groep bestaat uit benthische componenten (levend op of in de buurt van de bodem), namelijk gewortelde waterplanten en benthische cyanobacteriën (in cluster 2). Deze hebben minder negatieve signaturen voor δ13C: grofweg tussen -22 en -17.
Het verschil in koolstofsignatuur tussen de pelagische en benthische component wordt in meerdere aquatische systemen gevonden en komt waarschijnlijk door het verschil in belangrijkste koolstofbron [7]. De pelagische algen gebruiken meer kooldioxide uit de waterlaag, terwijl de benthische cyanobacteriën en gewortelde waterplanten voor hun anorganische koolstofvoorziening waarschijnlijk meer afhankelijk zijn van bicarbonaat uit de bodem. Bicarbonaat is meer verrijkt in de isotoop 13C [8].
Boven de algen komt zoöplankton voor in het voedselweb, in de vorm van onder andere watervlooien van het geslacht Daphnia, die de algen als voedselbron gebruikt. De Quaggamossel heeft een soortgelijke signatuur voor δ13C ( 30,3 ± 1,5) als het zoöplankton, maar staat iets hoger in het voedselweb dan Daphnia (δ15N Quaggamossel: 9,9 ± 1,1). Dit illustreert dat de Quaggamossel afhankelijk is van de pelagische basis van het voedselweb (filtreren van algen en vermoedelijk ook klein zoöplankton).
Consumenten direct boven de benthische basis in het voedselweb bestonden uit de vlokreeften Dikerogammarus haemobaphes en D. villosus. Mosselbeddetritus had een vergelijkbare signatuur als de vlokreeften. Vlokreeften hebben mosselbanken nodig en het hierin aanwezig detritus (waaronder ook de pseudofaeces van mosselen) is een belangrijke voedselbron [9].
Hoger in de voedselketen komen andere organismen voor als wormen en vissen (cluster 3 in afbeelding 4). De wormen (ringwormen, borstelwormen) en muggenlarven hebben een C-signatuur die ligt tussen de pelagische en benthische basis, maar hebben wel hogere N-signaturen. Vissen hebben tevens middelmatige C- en hogere N- signaturen (hoger in het voedselweb). Hierbij zit de Zwartbekgrondel gemiddeld het dichtst bij de benthische basis (δ13C -24,7) en de grotere Houting (Coregonus sp.) het dichtst bij de pelagische basis (δ13C -28,7). Baars (Perca fluviatilis), Snoekbaars (Sander lucioperca), Brasem (Abramis brama), Pos (Gymnocephalus cernuus) en Blankvoorn (Rutilus rutilus) liggen hier tussenin. De middelmatige C-signatuur wijst op een gemengd dieet van voedselbronnen uit beide voedselwebketens (pelagisch en benthisch).
Voor Pos, Baars, Snoekbaars en Houting werd een positief verband gevonden tussen de grootte van de vissen in de bekkens en δ15N. Grotere vissen namen een hogere trofische positie in dan de kleinere exemplaren van dezelfde soort. Snoekbaars groter dan 50 cm had de hoogste positie in het voedselweb met een δ15N van 16,6‰. Zo’n relatie werd niet gevonden voor de Zwartbekgrondel, Brasem en Blankvoorn. De positieve correlatie voor een aantal soorten kan verklaard worden door een verschuiving in het dieet als gevolg van de groei en ontwikkeling van de vissen. Grotere vissen kunnen fysiek gezien grotere prooien eten en verwerken. Het eten van prooien hoger in het voedselweb zal dan leiden tot hogere δ15N. Kleine snoekbaarzen eten bijvoorbeeld zoöplankton terwijl in de magen van grote snoekbaarzen veelal vissen werden gevonden.
Interacties in het voedselweb
De Quaggamossel werd in 2008 voor het eerst in de spaarbekkens waargenomen. Na 2008 ging de sterke toename van het aantal quaggamosselen gepaard met een sterke afname van het aantal (voorheen dominante) driehoeksmosselen (afbeelding 5). Deze snelle verdringing van de Driehoeksmossel is ook waargenomen in andere gebieden (o.a. [2]). De hoogste dichtheid aan quaggamosselen werd waargenomen in 2012, waarna de aantallen afnamen. Er is echter nog steeds een dichte mat aan quaggamosselen aanwezig.
De sterke opkomst van de Quaggamossel leidde tot veranderingen in het systeem: een daling van chlorofyl-α- en zoöplanktonbiomassa en een toename van het doorzicht [1]. Mosselen filtreren algen en (klein) zoöplankton uit het water als voedselbron en kunnen tevens in directe competitie zijn met zoöplankton om voedsel. Dit wordt bevestigd door de isotopenanalyse. De eveneens uitheemse vlokreeften (Dikerogammarus spp.) worden sinds 2007 gevonden en hebben in 2009 en 2011 relatief hoge dichtheden bereikt. Deze vlokreeften kunnen het voedselweb veranderen omdat ze vaak competitievere predatoren zijn dan de inheemse vlokreeften [10]. Tevens kunnen ze een belangrijke voedselbron zijn voor zwartbekgrondels [11].
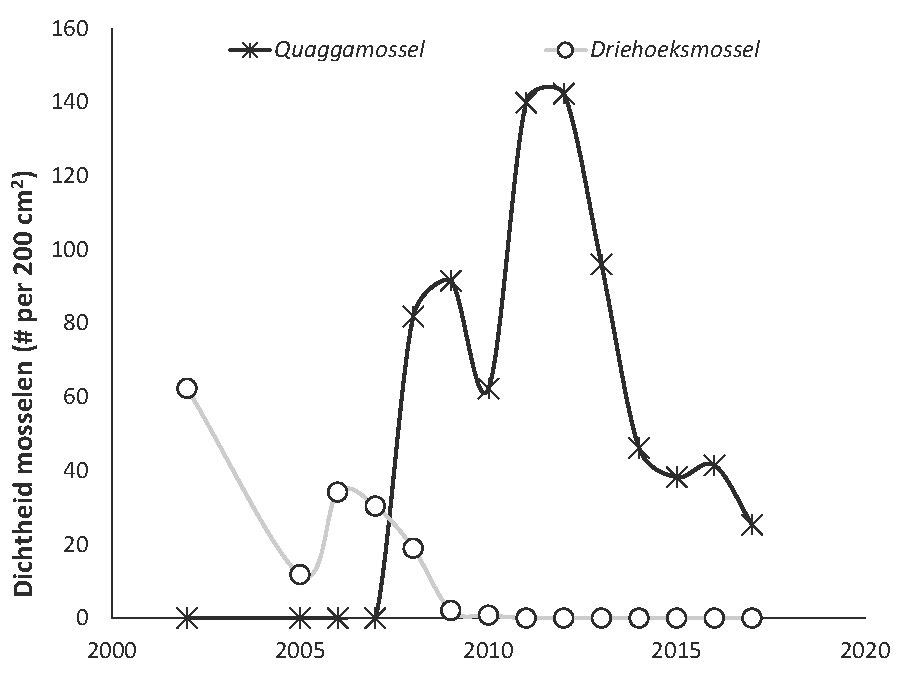
Afbeelding 5. Verloop in gemiddelde dichtheid van Dreissena-mosselen in de spaarbekkens
De resultaten van de vismonitoring laten duidelijke veranderingen zien in het aandeel van de verschillende vissoorten. In 2012 werd de Zwartbekgrondel voor het eerst in de spaarbekkens waargenomen, waarna er een sterke toename was [1], [12]. In het algemeen daalde het aandeel van de Pos, Snoekbaars, Brasem en (oudere) Blankvoorn na 2008. Pos nam sterk af na de komst van de Zwartbekgrondel (afbeelding 6).
Ook in vele andere gebieden waar de Zwartbekgrondel invasief is heeft dit geresulteerd in een afname van inheemse vissen, zoals de afname van de Rivierdonderpad (Cottus perifretum) in de Maas [4]. De Zwartbekgrondel is net als de Rivierdonderpad en de Pos een benthische vis. Aangezien er in de spaarbekkens relatief weinig variatie in habitattypen is, is het aannemelijk dat voedselcompetitie een belangrijke oorzaak is voor de achteruitgang van de Pos.

Afbeelding 6. Trends van de visbiomassa van pos en zwartbekgrondel (bewerkt naar [12])
De uitkomsten van het SIAR-model voor de Pos en Zwartbekgrondel geven weer dat er inderdaad een overlap was van voedselbronnen. Het dieet van de Zwartbekgrondel bleek op basis van de uitkomsten voornamelijk te bestaan uit vlokreeften (32-59%), quaggamosselen (15-38%), muggenlarven (4-29%) en vislarven (9-15%). Voor de Pos hadden de ringwormen het grootste aandeel (33-56%) gevolgd door quaggamosselen (15-40%), vlokreeften (3-22%) en muggenlarven (4-16%).
Dit geeft weer dat deels dezelfde voedselbronnen worden aangeboord, maar dat ze niet hetzelfde voedsel als hoofdbron hebben. In een experiment uitgevoerd door Bauer et al. [13] bleek de Zwartbekgrondel op een dieet van kleine invertebraten harder te groeien dan de Pos. Zwartbekgrondels zijn vaak opportunistisch in hun voedselkeuze, agressief en kunnen een negatieve invloed hebben op het schuilplaatsgebruik en de foerageerefficiëntie van andere vissen (zie referenties in [1]). Vóór de invasie van de Zwartbekgrondel in de spaarbekkens werden voornamelijk vlokreeften en muggenlarven gevonden in de magen van Pos. Na de invasie werden opvallend veel possen gevonden met een lege maag. Magen van zwartbekgrondels bevatten meestal resten van kleine kreeftachtigen, zoals vlokreeften, slakjes en vrijwel intacte quaggamosselen. Dit blijkt uit (ongepubiceerde) data van Evides.
In de literatuur [3], [14] wordt vaak gesuggereerd dat mosselen de belangrijkste voedselbron zijn voor zwartbekgrondels. De stabiele-isotopenanalyse van de voedselketen in de spaarbekkens laat echter zien dat niet mosselen, maar vlokreeften de belangrijkste voedselbron zijn. Ook Brush et al. [11] vonden dat vlokreeften een belangrijke voedselbron waren en dat de Quaggamossel minder belangrijk was. Overschatting uit maaginhouden kan mogelijk komen doordat de harde schelpen moeilijk verteerbaar zijn en het mosselvlees moeilijk uit de schelpen vrijkomt.
Conclusies
Stabiele-isotopenanalyse is een relatief simpele methode, die inzicht geeft in de structuur van een voedselweb en helpt om onderlinge relaties tussen soorten in beeld te brengen. Voor de Biesboschspaarbekkens is een sterke aanwijzing gevonden dat er competitie is tussen de inheemse Pos en de invasieve Zwartbekgrondel. De Zwartbekgrondel foerageert voornamelijk op vlokreeften die tussen de quaggamosselen leven. Omdat het een sterke opponent is van de eveneens benthische Pos heeft de grondel er waarschijnlijk voor gezorgd dat de Pos minder (geschikt) voedsel kan vinden.
Dit is zeer waarschijnlijk de oorzaak van de afname van de Pos-aantallen. Verder hebben de hoge dichtheden van de invasieve Quaggamossel een sterke invloed op het voedselweb door het efficiënt filtreren van het water en het bieden van een geschikt habitat voor met name vlokreeften. Hierdoor lijkt het benthische voedselweb in de spaarbekkens belangrijker te zijn geworden. De mosselen lijken niet de belangrijkste voedselbron te zijn voor de Zwartbekgrondel, wat vaak wel wordt gedacht vanwege de aanwezigheid van (vrijwel) intacte mosselen in de magen van de vissen.
REFERENTIES
1. Verstijnen, Y.J.M. et al. (2019). Trophic relationships in Dutch reservoirs recently invaded by Ponto-Caspian species: insights from fish trends and stable isotope analysis. Aquatic Invasions 14, 280-298.
2. Matthews, J. et al. (2014). Rapid range extension of the invasive quagga mussel in relation to zebra mussel presence in The Netherlands and Western Europe. Biological Invasions 16, 23–42.
3. Johnson, T.B., Bunnell, D.B., Knight, C.T. (2005). A potential new energy pathway in central Lake Erie: the round goby connection. Journal of Great Lakes Research 31, 238–251.
4. Kessel, N. van, Dorenbosch, M., Kranenbarg, J., Velde, G. van der, Leuven, R.S.E.W. (2016). Invasive Ponto-Caspian gobies rapidly reduce the abundance of native protected bullhead. Aquatic Invasions 11, 179–188.
5. Lucassen, E., Smolders, A., Wagenvoort, A., Castelijns, H., Ketelaars, H. (2018). Quaggamosselen verlagen de ecologische stabiliteit in de Biesboschbekkens. H2O-online, 22 januari 2018.
6. Mill, A.C., Pinnegar, J.K., & Polunin, N.V.C. (2007). Explaining isotope trophic‐step fractionation: why herbivorous fish are different. Functional Ecology 21, 1137-1145.
7. Mendonça, R. et al. (2013). Bimodality in stable isotope composition facilitates the tracing of carbon transfer from macrophytes to higher trophic levels. Hydrobiologia 710, 205–218.
8. Keeley, J.E., Sandquist, D.R. (1992). Carbon: Freshwater plants. Plant Cell and Environment 15, 1021–1035.
9. Gergs, R., Rothhaupt, K.O. (2008). Effects of zebra mussels on a native amphipod and the invasive Dikerogammarus villosus: the influence of biodeposition and structural complexity. Journal of the North American Benthological Society 27, 541–548.
10. Bacela-Spychalska, K., Velde, G. van der (2013). There is more than one ‘killer shrimp’: trophic positions and predatory abilities of invasive amphipods of Ponto‐Caspian origin. Freshwater Biology 58, 730–741.
11. Brush, J.M., Fisk, A.T., Hussey, N.E., Johnson, T.B. (2012). Spatial and seasonal variability in the diet of round goby (Neogobius melanostomus): stable isotopes indicate that stomach contents overestimate the importance of dreissenids. Canadian Journal of Fisheries and Aquatic Sciences 69, 573–586.
12. Jůza, T. et al. (2018). Collapse of the native ruffe (Gymnocephalus cernua) population in the Biesbosch lakes (the Netherlands) owing to round goby (Neogobius melanostomus) invasion. Biological Invasions 20, 1523–1535.
13. Bauer, C.R., Bobeldyk, A.M., Lamberti, G.A. (2007). Predicting habitat use and trophic interactions of Eurasian ruffe, round gobies, and zebra mussels in nearshore areas of the Great Lakes. Biological Invasions 9, 667–678.
14. Lederer, A.M., Janssen, J., Reed, T., Wolf, A. (2008). Impacts of the introduced round goby (Apollonia melanostoma) on dreissenids (Dreissena polymorpha and Dreissena bugensis) and on macroinvertebrate community between 2003 and 2006 in the littoral zone of Green Bay, Lake Michigan. Journal of Great Lakes Research 34, 690–697.